Accede al siguiente enlace para ver los videos de Quimitube (Teoría y ejercicios de Termoquímica)
domingo, 25 de octubre de 2015
Termoquímica. Actividades de aprendizaje Hoja Nº 4 (con problemas resueltos)
Calor de formación y de reacción (entalpías de formación y de reacción). Ley de Hess
1.- Durante la combustión de 1 mol de átomos de azufre en condiciones estándar se desprenden 296,8 kJ y durante la combustión de 1 mol de sulfuro de hidrógeno 560 kJ. Con estos datos determina la variación de entalpía que se produce en el proceso: 2 H2S (g) + SO2 (g) → 2 H2O (l) + 3 S (s).
2.- Dadas las entalpías estándar de formación: ΔHof [CO (g)] = –110,5 kJ/mol;
ΔHof [CO2(g)] = –393,5 kJ/mol. Hallar la entalpía de la siguiente reacción: CO (g) + ½ O2 (g) → CO2 (g)
ΔHof [CO2(g)] = –393,5 kJ/mol. Hallar la entalpía de la siguiente reacción: CO (g) + ½ O2 (g) → CO2 (g)
3.- Calcula el calor de formación a presión constante del CH3–COOH (l) (ácido acético) si conoces que los calores de combustión del C (s), H2 (g) y CH3–COOH) (l) son respectivamente –393,13, –285,9 y –870,7 kJ/mol.
4.- Calcula el calor de formación del ácido metanoico (HCOOH), a partir de los siguientes calores de reacción:
C (s) + ½ O2 (g) → CO (g); ΔH = –110,4 kJ
H2 (g) + ½ O2 (g) → H2O (l); ΔH = –285,5 kJ
CO (g) + ½ O2 (g) → CO2 (g); ΔH = –283,0 kJ
HCOOH(l) + ½O2 (g) → H2O(l) + CO2(g); ΔH = –259,6 kJ
H2 (g) + ½ O2 (g) → H2O (l); ΔH = –285,5 kJ
CO (g) + ½ O2 (g) → CO2 (g); ΔH = –283,0 kJ
HCOOH(l) + ½O2 (g) → H2O(l) + CO2(g); ΔH = –259,6 kJ
5.- Calcula el calor de formación a presión constante del metano (g) (CH4) a partir de los calores de combustión del C (s), H2 (g) y CH4 (g) cuyos valores son respectivamente 393,5, 285,9 y 890,4 kJ/mol.
6.- Para la fabricación industrial de ácido nítrico, la reacción de partida es la oxidación del amoniaco: 4 NH3 (g) + 5 O2 (g) → 6 H2O (g) + 4 NO (g). Calcular ΔH0reacción. Datos: ΔH0f (kJ/mol): NH3: –46,2; H2O: –241,8; NO: +90,4 kJ/mol
7.- En una fábrica de cemento es necesario aportar al horno 3300 kJ por cada kilogramo de producto. La energía se obtiene por combustión de gas natural (que se considerará metano puro) con aire. Se pide: a) Formule y ajuste la reacción de combustión del gas natural. b) Determine el calor de la combustión completa del gas natural c) Calcule, por tonelada de cemento producido, la cantidad necesaria del gas natural expresada en kg. d) ¿Cuantos metros cúbicos de aire medidos a 1atm y 25ºC serán necesarios para la combustión completa de la cantidad de gas natural del apartado e) Considere que la combustión del gas natural se realiza en condiciones estándar y que el aire contiene un 21% en volumen de oxigeno. ΔHºf : metano: –74,8kJ/mol; CO2: –393,5kJ/mol y H2O: –285,8kJ/mol R = 0,082 atm l/mol K ; Masas atómicas: C=12, H=1, O=16.
8.- a) Formule la reacción de formación del etanol. b) Calcule la entalpía de formación del etanol en condiciones estándar, sabiendo que la entalpía de combustión del etanol es –29,69 kJ/g, la entalpía de formación del dióxido de carbono es –393,34 kJ/mol y la entalpía de formación del agua líquida es –285 kJ/mol c) Interprete el resultado numérico obtenido en cuanto a su signo. Masas atómicas: C=12, H=1, O=16
Energía de enlace (enalpía de enlace)
10.- a) Define la magnitud denominada energía de enlace. b) ¿Cuál es la unidad internacional en que se mide la energía de enlace? c) ¿Cómo se puede calcular la entalpía de una reacción determinada si disponemos de una tabla de valores de energía de enlace? d) ¿Cómo se explica que la entalpía de enlace C=C no alcance el doble del valor de la entalpía del enlace C–C?
11.- Determina la entalpía normal de formación del metano, con lo siguientes datos:
ΔH0sublimación [C(g)] =716,7 kJ/mol; Eenlace [H–H] = 436,4 kJ/mol; Eenlace [C–H] = 415,3 kJ/mol.
12.ría medias de enlace (kJ/mo)
ΔH0sublimación [C(g)] =716,7 kJ/mol; Eenlace [H–H] = 436,4 kJ/mol; Eenlace [C–H] = 415,3 kJ/mol.
Energías medias de enlace (kJ/mol)
| |||
Enlace
|
Energía
|
Enlace
|
Energía
|
H–H
|
436
|
C=C
|
610
|
C–H
|
415
|
C=N
|
615
|
C–C
|
347
|
C–N
|
285
|
C–O
|
352
|
O=O
|
494
|
13.- A partir de las energías de enlace (Ee) (C H) = 415,3 kJ/mol; (Cl Cl) = 243,8 kJ/mol; (C Cl) = 327,8 kJ/mol; y (Cl H) = 432,4 kJ/mol, determinar la entalpía normal de reacción del proceso: CH4(g)+ Cl2(g) → CH3Cl(g) + Hcl(g)
Termoquímica. Actividades de aprendizaje Hoja Nº 3
LEY
DE HESS. Cálculo de la entalpía estándar de reacción a partir de
las entalpías estándar de formación
1.-
La reacción de oxidación catalítica del amoníaco es el punto de
partida para la obtención industrial del ácido nítrico y sucede
según la ecuación siguiente: 4 NH3
(g) 5 O2
(g) → 6 H2O
(l) + 4 NO (g).Calcula la entalpía de esta reacción utilizando
datos de la tabla de entalpías estándar de formación. Sol: ΔHo=
-1168 kJ
Datos ΔHof [NH3(g)]=-46,3 kJ·mol-1; ΔHof [O2(g)]= 0; ΔHof [H2O(l)]=-285,8 kJ·mol-1;ΔHof [NO(g)]=+90,4 kJ·mol-1
Datos ΔHof [NH3(g)]=-46,3 kJ·mol-1; ΔHof [O2(g)]= 0; ΔHof [H2O(l)]=-285,8 kJ·mol-1;ΔHof [NO(g)]=+90,4 kJ·mol-1
2.-
Calcula
la entalpía estándar de la reacción de síntesis del disulfuro de
carbono, CS2
(l), a partir de sus elementos, C (grafito), y azufre, S(s). A
partir de estos datos:
C (grafito) + O2 (g) → CO2 (g) ΔHo=-393,5 kJ S(s) + O2(g) → SO2 (g) ΔHo= -296,1 kJ
CS2 (s) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ΔHo=-1072 kJ Sol: 86,3 kJ
3.- Formula la reacción de descomposición del CaCO3 (s) y calcula la entalpía estándar a partir de los datos de las entalpías de formación. Sol: +177,8 kJ
C (grafito) + O2 (g) → CO2 (g) ΔHo=-393,5 kJ S(s) + O2(g) → SO2 (g) ΔHo= -296,1 kJ
CS2 (s) + 3 O2 (g) → CO2 (g) + 2 SO2 (g) ΔHo=-1072 kJ Sol: 86,3 kJ
3.- Formula la reacción de descomposición del CaCO3 (s) y calcula la entalpía estándar a partir de los datos de las entalpías de formación. Sol: +177,8 kJ
Datos:
ΔHof
[CO(g)]=-393,5 kJ·mol-1;
ΔHof
[CaO(s)]=-635,6 kJ·mol-1;
ΔHof
[CaCo3(s)]=-1206,9
kJ·mol-1
4.- Formula la reacción de síntesis de un mol de metanol CH3OH (l) y calcula la entalpía de la reacción a partir de la siguientes ecuaciones termoquímicas: Sol: -238,7 kJ
CH3OH (l) + 3/2 O2 (g) → CO2 (g) + H2O (l) ΔHo=-726,4 kJ
C (grafito) + O2 (g) → CO2 (g) ΔHo=-393,5 kJ H2 (g) + ½ O2 (g) →H2O (l) ΔHo=-285,8 kJ
4.- Formula la reacción de síntesis de un mol de metanol CH3OH (l) y calcula la entalpía de la reacción a partir de la siguientes ecuaciones termoquímicas: Sol: -238,7 kJ
CH3OH (l) + 3/2 O2 (g) → CO2 (g) + H2O (l) ΔHo=-726,4 kJ
C (grafito) + O2 (g) → CO2 (g) ΔHo=-393,5 kJ H2 (g) + ½ O2 (g) →H2O (l) ΔHo=-285,8 kJ
Cálculo
de la entalpía estándar de reacción a partir de las entalpías de
enlace
5.- Calcula la entalpía estándar de la reacción de combustión del gas hidrógeno, según la ecuación siguiente, a partir de los datos que aparecen en la tabla de entalpías de enlace: 2 H2 (g) + O2 (g) → 2 H2O (l)
ΔHH-H= 436,4 kJ·mol-1; ΔHO=O = 498,7 kJ·mol-1; ΔHO-H= 460,4 kJ·mol-1 Sol: - 468,5 kJ·mol-1
6.- Utilizando los valores de las entalpías de enlace que aparecen en las tablas (se incluyen), determina con carácter aproximado la entalpía estándar de cada una de las siguientes reacciones:
a) Br2 (g) + 3 F2 (g) → 2 BrF3 (g) Sol: - 537,7 kJ
5.- Calcula la entalpía estándar de la reacción de combustión del gas hidrógeno, según la ecuación siguiente, a partir de los datos que aparecen en la tabla de entalpías de enlace: 2 H2 (g) + O2 (g) → 2 H2O (l)
ΔHH-H= 436,4 kJ·mol-1; ΔHO=O = 498,7 kJ·mol-1; ΔHO-H= 460,4 kJ·mol-1 Sol: - 468,5 kJ·mol-1
6.- Utilizando los valores de las entalpías de enlace que aparecen en las tablas (se incluyen), determina con carácter aproximado la entalpía estándar de cada una de las siguientes reacciones:
a) Br2 (g) + 3 F2 (g) → 2 BrF3 (g) Sol: - 537,7 kJ
b)
Hidrogenación de eteno con formación de etano: CH2═CH2
(g) + H2
(g) → CH3─CH3
(g) Sol: -118,6 kJ
c)
Combustión del etanol: C2H5OH
(g) + 3 O2
(g) → 2 CO2
(g) + 3 H2O
(g) Sol: 1015,9 kJ.
ENTROPÍA:
Cálculo de la variación de entropía en procesos químicos
7.- Calcula la variación de entropía que experimenta un mol de hielo al fundir a la temperatura de 0 ºC y a la presión externa de 1 atm, según la ecuación; H2O (s) ↔H2O (l). Calor de fusión latente del hielo, LF= 334.000 J·kg-1. Supón que el proceso de fusión del hielo es reversible. Sol: ΔS= 22,05 J·K-1
Entropía molar estándar
8.- Calcula el cambio de entropía estándar de 100 g de agua cuando se congela a 0 ºC.
7.- Calcula la variación de entropía que experimenta un mol de hielo al fundir a la temperatura de 0 ºC y a la presión externa de 1 atm, según la ecuación; H2O (s) ↔H2O (l). Calor de fusión latente del hielo, LF= 334.000 J·kg-1. Supón que el proceso de fusión del hielo es reversible. Sol: ΔS= 22,05 J·K-1
Entropía molar estándar
8.- Calcula el cambio de entropía estándar de 100 g de agua cuando se congela a 0 ºC.
Datos:
So
[H2O
(s)]= 43,2 J·mol-1·K-1;
So
[H2O
(l)]= 69,9 J·mol-1·K-1 Sol:
- 148, 3 J·K-1
9.-
Calcula
el cambio de entropía en el proceso etanol (l) →etanol (g),
supuesto éste reversible, sabiendo que el calor molar de
vaporización del etanol a 25 ºC es 36,4 kJ·mol-1.
Si la
entropía estándar del etanol líquido es 161 J·mol-1K-1,
calcula la entropía estándar del vapor de etanol. Sol: 122
J·mol-1·K-1;
283 J·mol-1K-1
Entropía estándar de reacción
10.- A partir de los datos de la tabla de entropías molares estándar, calcula la variación de entropía que tiene lugar en las reacciones siguientes: a) CaCO3 (s) → CO2 (g) + CaO (s); b) N2 (g) + 3 H2 (g) → 2 NH3
Entropía estándar de reacción
10.- A partir de los datos de la tabla de entropías molares estándar, calcula la variación de entropía que tiene lugar en las reacciones siguientes: a) CaCO3 (s) → CO2 (g) + CaO (s); b) N2 (g) + 3 H2 (g) → 2 NH3
Sol:
ΔSo=
160,5 J·K-1;
ΔSo=
- 199 J·K-1
11.-
Calcula
la variación de entropía en las siguientes reacciones en
condiciones estándar:
a)
H2
(g) +Cl2
(g) →2 HCl (g); b) S (s) + O2
(g) → SO2
(g); c) MgCO3
(s) → MgO (s) + CO2
(g)
Sol:
20 J·K-1;
11,6 J·K-1;
174,7 J·K-1
12.-
Predice
si en cada una de las siguientes reacciones hay aumento o disminución
de la entropía:
a) Ag+ (aq) + Cl- (aq) → AgCl (s); b) NH4Cl (s) → NH3 (g) + HCl (g); c) H2 (g) + Br2 (g) → 2 HBr (g)
a) Ag+ (aq) + Cl- (aq) → AgCl (s); b) NH4Cl (s) → NH3 (g) + HCl (g); c) H2 (g) + Br2 (g) → 2 HBr (g)
Simulaciones: Energía de las reacciones químicas
En esta animación podeís estudiar todo lo que afecta a la energía de las reacción químicas: entalpía de reacción, ley de Hess, energía libre...
Recurso flash ¿Cómo se aplica la ley de Hess para hallar la entalpía de una reacción?
Puedes aprenderte la ley de Hess con el siguiente ejemplo, explicado paso a paso:
martes, 13 de octubre de 2015
Termoquímica. Actividades de aprendizaje Hoja Nº 2
Primer
principio de la termodinámica. Relación Qv
y
QP.
ΔU=
Qv
y ΔH= Qp
- Determina la variación de entalpía de un sistema que en cierto proceso disminuyó en 100 kJ su energía interna y desarrolló un trabajo de expansión de 10 kJ a presión contante. Sol: - 90 kJ
- Con los datos anteriores, calcula el calor cedido a presión constante y el calor que cedería si el proceso se hubiera producido a volumen contante. Sol.:Qp= - 90 kJ y Qv= - 100 kJ.
- Indica a qué tipo de procesos corresponden las condiciones siguientes:
a) El calor transferido a
un sistema es igual al cambio de su energía interna.
b) La variación de
energía interna es igual al trabajo intercambiado.
c) El calor y el trabajo
intercambiados son cantidades de igual valor absoluto.
- En los procesos termodinámicos que se llevan a cabo con líquidos y sólidos puede decirse que ΔU y ΔH son prácticamente iguales. Explica porqué.
- En un proceso adiabático, un sistema desarrolla un trabajo de 150 J. Calcula la variación que experimenta su energía interna. Sol.: - 150 J.
- Cierta reacción tiene lugar mediante absorción de 4,05 kJ a la presión constante de 1 atm y con desprendimiento de gases que producen un aumento de volumen de 3 L. Determina el cambio de entalpía durante la reacción, el trabajo de expansión desarrollado y la variación de la energía interna.
Sol.: ΔH= 4050 J, W= -
303,9 J y ΔU= 3646,1 J.
- Se quema una muestra de etanol, C2H5OH, de 1,0 g en una bomba calorimétrica a volumen constante según la ecuación: C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l).
La
bomba contiene 3,0 kg de agua y la temperatura d e ésta se eleva
dede 24,3 ºC a 26,2 ºC. Calcula, en kJ·mol-1,
la variación de la energía interna que tuvo lugar en la combustión
y el calor de combustión del etanol a presión constante y a 25º C.
(Datos complementarios: capacidad colorífica específica del agua:
4180 J·kg-1·ºC-1;
equivlante en agua del calorímetro: 0,647 kg).
Sol.:
ΔU= -1334,19 kJ·mol-1
y Qp=
- 1336,67 kJ·mol-1
- Se queman en una bomba calorimétrica 1,44 g de naftaleno, C10H8, a volumen constante, de modo que la temperatura de los 2000 g de agua del calorímetro aumenta desde 20,2 ºC a 25,8 ºC. Calcula el calor de combustión del naftaleno a volumen constante, en kJ·mol-1 (equivalente en agua del calorímetro: 430 g). Sol.: - 5,06·103 kJ·mol-1.
- Un mol de nitrógeno reaccona a volumen constante y a 25 ºC con el hidrógeno según la reación N2 (g) + 3 H2 (g) → 2 NH3 (g). El calor producido es de 41 kJ. Calcula el valor del calor de combustión molar si esta reacción sucede a la misma temperatura y a la presión constante de 1 atm. Sol.: - 45,95 kJ·mol-1
Entalpía
estándar de reacción y de formación.
- Calcula cuántos gramos de propano deben quemarse para producir 700 kJ según la reacción C3H8 (g) + 5 O2 (g) → 3 CO2 (g) + H2O (l). ΔHo= - 2220 kJ·mol-1. Sol.: 13,90 g.
- Formula la ecuación de combustión del butano, C4H10, y calcula cuántos gramos de esta sustancia hay que quemar para producir 350 kJ, sabiendo que su entalpía estándar de combustión es ΔHo= - 2877 kJ·mol-1. Sol.: 7,07 g
- Calcula cuánto calor se producirá en condiciones estándar cuando reaccionen totalmente 25 kg de CaO en la reacción denominada apagado de la cal viva: CaO (s) + H2O (l) → Ca(OH)2 (s). Δho= -65,21 kJ. Sol.: 2,91·104 kJ.
- Considerando la gasolina como octano puro, C8H18, calcula el calor producido cuando se quema totalmente 1 L de gasolina en condiciones estándar. (densidad gasolina: 800 kg·m-3; calor de combustión del octano: - 5471 kJ·mol-1.
- Formula la reacción de combustión del metano y calcula cuántos kilogramos de este gas debe quemarse en condiciones estándar para producir 3,7·106 kJ de calor si se sabe que sólo se aprovecha el 75% del calor obtenido en la combustión. Sol.: 64,89 kg
lunes, 12 de octubre de 2015
Termoquímica: Videos de Quimitube
Puedes ver las "clases" de Quimitube, que te ayudarán a entender conceptos básicos para trabajar en Termoquímica.
Termoquímica: 1. Introducción a la termodinámica
Termoquímica: 2. Variables termodinámicas y funciones de estado
Termoquímica: 3. Transferencia de energía como trabajo. Trabajo de expansión y comprensión de un gas
Termoquímica:4. Transferencia de calor. Capacidad calorífica específica y molar
Termoquímica: 5. Primer principio de la termodinámica en reacciones químicas. Energía interna U
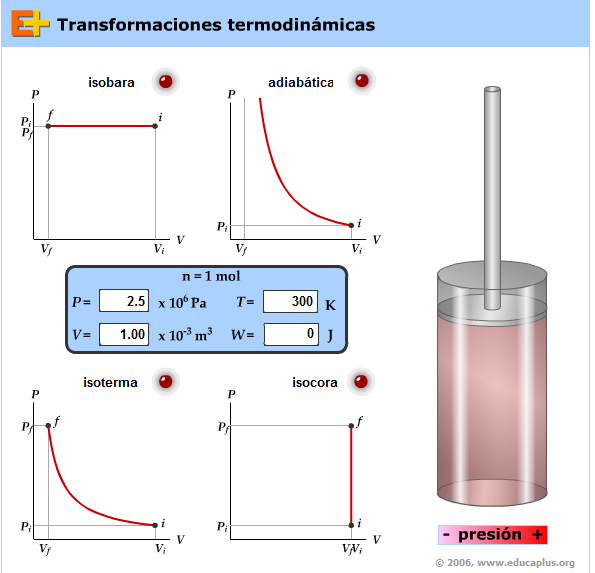
Termoquímica: Simulación para comprender las transformaciones termodinámicas
Termoquímica: Resumen en diapositivas
Puedes acceder al siguiente resumen de la unidad 1, Termoquímica.
Unidad 1. Termoquímica. Contenidos y Criterios de evalución. Actividades Hoja nº 1
CONTENIDOS
1. Transferencia de energía: calor y trabajo. Propiedades intensivas y extensivas. Función de estado.2. La energía interna. Primer principio de la termodinámica.
3. Calor de reacción a presión constante. Concepto de entalpía. Ecuaciones termoquímicas.
4. Ley de Hess. Entalpías de formación y entalpías de enlace. Cálculo de entalpías de reacción.
5. Repercusiones sociales y medioambientales del uso de los combustibles fósiles. El aumento del efecto invernadero. Combustibles alternativos. Importancia del uso de fuentes de energía renovables en Canarias.
6. El valor energético de los alimentos y su relación con la salud.
7. La entropía. Segundo principio de la termodinámica.
8. La energía libre de Gibbs. Criterio de espontaneidad de una reacción química.
CRITERIOS DE EVALUACIÓN
Comprender el significado de entalpía y entropía, calcular su variación en una reacción química, predecir la espontaneidad en distintas condiciones y valorar la importancia de las reacciones de combustión así como los problemas ambientales que generan y las repercusiones sociales que producen.
El propósito de este criterio es comprobar si el alumnado conoce que todos los procesos químicos van acompañados de un intercambio energético, si distingue entre procesos endotérmicos y exotérmicos y si es capaz de calcular entalpías de reacción haciendo uso de la Ley de Hess. Igualmente, se trata de comprobar si el alumnado comprende cómo influyen los aspectos entálpico y entrópico en la espontaneidad de una reacción química, para emitir hipótesis sobre las condiciones en que determinados procesos de interés industrial o biológico pueden ser espontáneos.
HOJA DE ACTIVIDADES Nº 1
CONCEPTOS
BÁSICOS QUE HAY QUE DOMINAR:
Actividad
1.- Busca
información y trata de explicar y definir los siguientes conceptos
relacionados con la termodinámica:
a)
Reacciones endotérmicas.
b)
Reacciones exotérmicas.
c)
Sistema termodinámico: sistema abierto, cerrado y aislado.
d)
Variables termodinámicas y funciones de estado:Variables extensivas:
(masa y volumen), variables intensivas (temperatura, densidad o
presión) y Funciones de estado (la presión, el volumen y la
temperatura).
e)
Procesos termodinámicos y equilibrios termodinámicos.
PRIMER
PRINCIPIO DE LA TERMODINÁMICA:
El
primer principio de la termodinámica dice que la variación de
energía
interna,
ΔU,
de un sistema es igual a la suma del
calor, Q,
intercambiado entre el sistema y su entorno, y el
trabajo, W,
realizado por el sistema o sobre éste. ΔU=
Q + W.
Actividad
2.- ¿Cuando
se consideran el flujo de calor y el de trabajo positivos? ¿Y
negativos?
Actividad
3.- ¿Cuál
es el convenio de signos si el sistema absorbe calor y realiza
trabajo? ¿Y si el sistema cede calor y se realiza trabajo sobre él?
Actividad
4.- ¿Cómo
se determina el trabajo en aquellos sistemas donde sólo interviene
la presión y el volumen? (el denominado trabajo de expansión y de
comprensión).
Actividad
5.- Explica
en qué consisten los procesos termodinámicos denominados
isotérmicos,
adiabáticos, isocóricos e isobáricos.
Aplica a cada uno de ellos el primer principio de la termodinámica.
Actividad
6.- Tanto
la energía interna como la entalpía son funciones de estado. ¿A
qué llamamos variación
de entalpía, ΔH?
Actividad
7.- ¿Qué
relación existe entre los procesos a volumen constante y a presión
constante, es decir, entre el calor isocórico y el calor isobárico?
Suscribirse a:
Comentarios (Atom)